El Tabla periódica de elementos es una disposición sistemática de 118 elementos químicos conocidos. Estos elementos químicos están organizados en orden creciente de número atómico. Las filas horizontales de izquierda a derecha se llaman períodos, mientras que las columnas verticales de arriba a abajo se llaman grupos en una tabla periódica.
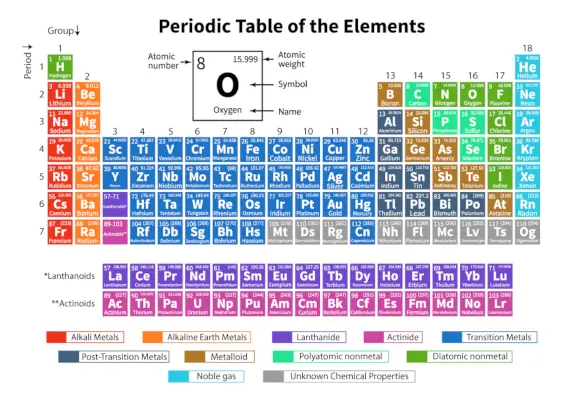
Tabla de contenidos
- ¿Qué es la tabla periódica?
- Lista de elementos de la tabla periódica
- Términos importantes en la tabla periódica
- Clasificación de elementos en la tabla periódica.
- Tabla periódica de Mendeleev
- Preguntas frecuentes sobre la tabla periódica de elementos
¿Qué es la tabla periódica?
Una tabla periódica es una representación tabular en la que todos los elementos químicos conocidos están ordenados en filas horizontales llamadas períodos y columnas verticales llamadas grupos según su número atómico y estructura atómica respectivamente.
Es una disposición de todos los elementos conocidos y, por lo tanto, proporciona información sobre los elementos, como su masa, número de electrones, configuración electrónica y sus propiedades químicas únicas.
Lista de elementos de la tabla periódica
Aquí está la tabla que representa los 118 elementos de la tabla periódica. Los elementos enumerados están ordenados según el orden creciente de número atómico y su respectivo peso atómico, símbolo, densidad y electronegatividad.
| Elementos de la tabla periódica con masa atómica | |||||
|---|---|---|---|---|---|
| Número atómico | Nombre del elemento químico | Símbolo | Masa atómica (uma) | Densidad (g/cm 3 ) | Electronegatividad |
| 1 | Hidrógeno | h | 1.0079 | 0.00008988 | 2.2 |
| 2 | Helio | Él | 4.0026 | 0.0001785 | – |
| 3 | Litio | Eso | 6.941 | 0.534 | 0.98 |
| 4 | Berilio | Ser | 9.0122 | 1.85 | 1.57 |
| 5 | Boro | B | 10.811 | 2.34 | 2.04 |
| 6 | Carbón | C | 12.0107 | 2.267 | 2.55 |
| 7 | Nitrógeno | norte | 14.0067 | 0.0012506 | 3.04 |
| 8 | Oxígeno | oh | 15.9994 | 0.001429 | 3.44 |
| 9 | Flúor | F | 18.9984 | 0.001696 | 3.98 |
| 10 | Neón | Sí | 20.1797 | 0.0009002 | – |
| 11 | Sodio | Ya | 22.9897 | 0.968 | 0.93 |
| 12 | Magnesio | magnesio | 24.305 | 1.738 | 1.31 |
| 13 | Aluminio | Al | 26.9815 | 2.7 | 1.61 |
| 14 | Silicio | Si | 28.0855 | 2.329 | 1.9 |
| 15 | Fósforo | PAG | 30.9738 | 1.823 | 2.19 |
| 16 | Azufre | S | 32.065 | 2.07 | 2.58 |
| 17 | Cloro | CL | 35.453 | 0.0032 | 3.16 |
| 18 | Argón | Con | 39.948 | 0.001784 | – |
| 19 | Potasio | k | 39.0983 | 0.89 | 0.82 |
| 20 | Calcio | Eso | 40.078 | 1.55 | 1 |
| 21 | Escandio | Carolina del Sur | 44.9559 | 2.985 | 1.36 |
| 22 | Titanio | De | 47.867 | 4.506 | 1.54 |
| 23 | Vanadio | EN | 50.9415 | 6.11 | 1.63 |
| 24 | Cromo | cr | 51.9961 | 7.15 | 1.66 |
| 25 | Manganeso | Minnesota | 54.938 | 7.21 | 1.55 |
| 26 | Hierro | Fe | 55.845 | 7.874 | 1.83 |
| 27 | Cobalto | Co | 58.9332 | 8.9 | 1.88 |
| 28 | Níquel | En | 58.6934 | 8.908 | 1.91 |
| 29 | Cobre | Con | 63.546 | 1.9 | 60 |
| 30 | Zinc | zinc | 65.39 | 1.65 | 70 |
| 31 | Galio | Aquí | 69.723 | 1.81 | 19 |
| 32 | Germanio | Ge | 72.64 | 2.01 | 1.5 |
| 33 | Arsénico | Como | 74.9216 | 2.18 | 1.8 |
| 34 | Selenio | Se | 78.96 | 2.55 | 0.05 |
| 35 | Bromo | hermano | 79.904 | 2.96 | 2.4 |
| 36 | Criptón | NO OK | 83.798 | 3 | 1×10−4 |
| 37 | Rubidio | Rb | 85.4678 | 0.82 | 90 |
| 38 | Estroncio | Sr. | 87.62 | 0.95 | 370 |
| 39 | Itrio | Y | 88.906 | 1.22 | 33 |
| 40 | Circonio | zr | 91.224 | 1.33 | 165 |
| 41 | Niobio | Nótese bien | 92.906 | 1.6 | 20 |
| 42 | Molibdeno | Mes | 95.94 | 2.16 | 1.2 |
| 43 | tecnecio | tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Rutenio | ru | 101.07 | 2.2 | 0.001 |
| 45 | Rodio | Rh | 102.91 | 2.28 | 0.001 |
| 46 | Paladio | PD | 106.42 | 2.2 | 0.015 |
| 47 | Plata | En | 107.87 | 1.93 | 0.075 |
| 48 | Cadmio | Cd | 112.411 | 1.69 | 0.159 |
| 49 | indio | En | 114.82 | 1.78 | 0.25 |
| 50 | Creer | sn | 118.71 | 1.96 | 2.3 |
| 51 | Antimonio | sb | 121.76 | 2.05 | 0.2 |
| 52 | Telurio | El | 127.6 | 2.1 | 0.001 |
| 53 | Yodo | I | 126.9045 | 2.66 | 0.45 |
| 54 | Xenón | Auto | 131.293 | 2.6 | 3×10−5 |
| 55 | Cesio | cs | 132.91 | 0.79 | 3 |
| 56 | Bario | No | 137.327 | 0.89 | 425 |
| 57 | Lantano | La | 138.91 | 1.1 | 39 |
| 58 | Cerio | Este | 140.12 | 1.12 | 66.5 |
| 59 | Praseodimio | pr | 140.9077 | 1.13 | 9.2 |
| 60 | Neodimio | Dakota del Norte | 144.24 | 1.14 | 41.5 |
| 61 | Prometeo | Pm | 145 | 1.13 | 2×10−19 |
| 62 | Samario | sm | 150.36 | 1.17 | 7.05 |
| 63 | europio | UE | 151.964 | 1.2 | 2 |
| 64 | Gadolinio | Dios | 157.25 | 1.2 | 6.2 |
| 65 | Terbio | Tuberculosis | 158.9253 | 1.2 | 1.2 |
| 66 | disprosio | Aquellos | 162.5 | 1.22 | 5.2 |
| 67 | Holmio | A | 164.9303 | 1.23 | 1.3 |
| 68 | Erbio | Es | 167.259 | 1.24 | 3.5 |
| 69 | Tulio | tm | 168.9342 | 1.25 | 0.52 |
| 70 | Iterbio | yb | 173.04 | 1.1 | 3.2 |
| 71 | París | Lu | 174.967 | 1.27 | 0.8 |
| 72 | Hafnio | hf | 178.49 | 1.3 | 3 |
| 73 | tantalio | Frente a | 180.9479 | 1.5 | 2 |
| 74 | Tungsteno | EN | 183.84 | 2.36 | 1.3 |
| 75 | renio | Re | 186.207 | 1.9 | 7×10−4 |
| 76 | Osmio | Tú | 190.23 | 2.2 | 0.002 |
| 77 | Iridio | Y | 192.22 | 2.2 | 0.001 |
| 78 | Platino | punto | 195.08 | 2.28 | 0.005 |
| 79 | Oro | En | 196.97 | 2.54 | 0.004 |
| 80 | Mercurio | Hg | 200.59 | 2 | 0.085 |
| 81 | talio | tl | 204.3833 | 1.62 | 0.85 |
| 82 | Dirigir | Pb | 207.2 | 1.87 (2+) 2.33 (4+) | 14 |
| 83 | Bismuto | Con un | 208.9804 | 2.02 | 0.009 |
| 84 | Polonio | Después | 209 | 2 | 2×10−10 |
| 85 | Astato | En | 210 | 2.2 | 3×10−20 |
| 86 | Radón | Rn | 222 | 2.2 | 4×10−13 |
| 87 | francio | fr. | 223 | >0.79[6] | ~ 1×10−18 |
| 88 | Radio | Sol | 226 | 0.9 | 9×10−7 |
| 89 | Actinio | Y | 227 | 1.1 | 5.5×10−10 |
| 90 | Torio | Th | 232.0381 | 1.3 | 9.6 |
| 91 | Protactinio | Bien | 231.0359 | 1.5 | 1.4×10−6 |
| 92 | Uranio | EN | 238.0289 | 1.38 | 2.7 |
| 93 | Neptuno | P.ej | 237 | 1.36 | ≤ 3×10−12 |
| 94 | Plutonio | Podría | 244 | 1.28 | ≤ 3×10−11 |
| 95 | Americio | Soy | 243 | 1.13 | – |
| 96 | Curio | Cm | 247 | 1.28 | – |
| 97 | Berkelio | bk | 247 | 1.3 | – |
| 98 | California | cf | 251 | 1.3 | – |
| 99 | einstenio | Es | 252 | 1.3 | – |
| 100 | Fermio | fm | 257 | 1.3 | – |
| 101 | Mendeleev | Maryland | 258 | 1.3 | – |
| 102 | Noble | No | 259 | 1.3 | – |
| 103 | lawrencio | lr | 262 | 1.3 | – |
| 104 | Rutherfordio | RF | 267 | – | – |
| 105 | dubnio | Db | 268 | – | – |
| 106 | Seaborgio | sg | 269 | – | – |
| 107 | bohrio | bh | 270 | – | – |
| 108 | hasio | hs | 269 | – | – |
| 109 | meitnerio | Monte | 277 | – | – |
| 110 | Darmstadtio | ds | 281 | – | – |
| 111 | roentgenio | rg | 282 | – | – |
| 112 | Copérnico | cn | 285 | – | – |
| 113 | nihonio | Nueva Hampshire | 286 | – | – |
| 114 | flerovio | En | 290 | – | – |
| 115 | moscovio | Mc | 290 | – | – |
| 116 | hígado | Lv | 293 | – | – |
| 117 | Tennessee | ts | 294 | – | – |
| 118 | Oganesson | Y | 294 | – | – |
Términos importantes en la tabla periódica
| Términos variables de tipo java | Descripción |
|---|---|
| Número atómico | El número de protones que constituye el núcleo de un elemento se llama Número Atómico (Z). p.ej. Entonces el carbono contiene 6 protones, por lo que su número atómico debe ser sólo 6. |
| Masa atomica | Se define como la masa promedio de los átomos de un elemento. Se mide sobre la base de la abundancia natural relativa de los isótopos del elemento. Masa atomica También se denomina peso atómico (A). Se mide en la unidad de masa atómica (uma). |
| Período | Las filas horizontales de izquierda a derecha en una tabla periódica se llaman períodos. Hay un total de 7 periodos en la tabla periódica. Los elementos están dispuestos horizontalmente debido a sus similitudes en propiedades, como los mismos orbitales atómicos, etc. |
| Grupo | Las columnas verticales de arriba a abajo en una tabla periódica se llaman grupos. Hay un total de 18 grupos en la tabla periódica. Los elementos están dispuestos verticalmente debido a sus similitudes en propiedades, ya que tienen el mismo número de electrones de valencia. |
| Símbolo de un elemento | Un símbolo es una noción que se utiliza para representar un elemento químico mediante una letra o una combinación de dos o tres letras. p.ej. El símbolo químico del carbono es C, mientras que Fe se utiliza para el hierro, etc. |
Clasificación de elementos en la tabla periódica.
Los 118 elementos están organizados en 7 períodos y 18 grupos como se muestra arriba. Además, los elementos se dividen en diferentes bloques.
| Bloquear | Elementos incluidos | Última subcapa de electrones llena |
|---|---|---|
| bloque s | Grupo 1 (Metales alcalinos) | subcapa s |
| Grupo 2 (Metales alcalinotérreos) | ||
| bloque p | Grupo 13 (Familia Boro) | subcapa p |
| Grupo 14 (Familia del Carbono) | ||
| Grupo 15 (Familia del Nitrógeno) | ||
| Grupo 16 (Familia del Oxígeno) | ||
| Grupo 17 (Familia del Flúor) | ||
| bloque d | Grupos 3 al 12 (Elementos de Transición) | subcapa d |
| bloque f | Lantánidos (elementos de tierras raras) | subcapa f |
| actínidos |
Tabla periódica de Mendeleev
Para representar similitudes y tendencias en el comportamiento de los elementos, Mendeleev desarrolló la tabla periódica, que es una disposición de los elementos en un orden creciente de masa atómica en forma tabular.

Según la tabla periódica de Mendeleev, los elementos estaban ordenados según sus propiedades fundamentales, masa atómica y características químicas. En la época del trabajo de Mendeleev sólo se conocían 63 elementos. En la tabla periódica de Mendeleev, la fila horizontal y las columnas verticales se denominaban grupos y períodos, respectivamente.
Sin embargo, la tabla periódica de Mendeleev falla debido a muchos defectos. Algunas de ellas son que no designó en él el hidrógeno ni los gases nobles. Además, el orden creciente de la masa atómica de los elementos no era regular en toda la tabla. Incluso, el descubrimiento de isótopos viola la Ley Periódica de Mendeleev.
Leer más:
- Tabla periódica moderna
- tabla periódica de mendeleev
- Ley periódica moderna
- Historia de la tabla periódica
- Estructura atomica
Preguntas frecuentes sobre la tabla periódica de elementos
¿Qué es la tabla periódica de elementos?
La tabla periódica de elementos es una disposición tabular de elementos químicos organizados por su número atómico, configuración electrónica y propiedades químicas recurrentes. La tabla se divide en filas llamadas períodos y columnas llamadas grupos o familias.
¿Quién descubrió la tabla periódica de elementos?
La tabla periódica de elementos no fue descubierta por una sola persona, pero su desarrollo se atribuye a Dmitri Mendeleev, un químico ruso, quien ordenó los elementos según sus propiedades en 1869.
¿Quién creó la tabla periódica moderna?
En 1913, Henry Moseley introdujo una versión actualizada de la tabla periódica, comúnmente conocida como la tabla periódica moderna.
¿Cómo está organizada la tabla periódica?
La tabla periódica está organizada en orden creciente de número atómico, con elementos agrupados según propiedades químicas similares y organizados en períodos (filas) y grupos (columnas).
¿Qué es el número atómico?
El número de protones que constituye el núcleo de un elemento se llama Número Atómico (Z). p.ej. El carbono contiene 6 protones, entonces su número atómico debe ser 6 solamente.
¿Pueden dos elementos diferentes tener el mismo número atómico?
El número de neutrones en un átomo de dos elementos diferentes puede ser similar, pero el número de protones nunca será el mismo. Cada elemento tiene un número específico de protones, que corresponde al número de átomos.
¿Cómo calcular la masa atómica?
La masa atómica se puede calcular sumando la masa de protones y neutrones en un elemento.
¿Qué es un grupo en la tabla periódica?
La columna de la tabla periódica se refiere al grupo de la tabla periódica. Los elementos del mismo grupo tienen propiedades físicas y químicas similares.
