El Principio de Aufbau es el método básico que nos dice cómo se llenan los electrones en el orbital atómico. Según el principio de Aufbau, el llenado de los electrones en el estado fundamental de un átomo sigue un patrón básico. Este principio nos dice que los electrones en el orbital atómico de cualquier átomo se llenan en orden ascendente de su energía y para encontrar la energía del orbital atómico siguen la regla n+l.
Principio de estructura
En este artículo, aprenderemos en detalle sobre el Principio de Aufbau, las características del Principio de Aufbau, sus excepciones y limitaciones.
Definición del principio de estructura
El principio de Aufbau establece que
Los electrones en diferentes orbitales se llenan en orden creciente de su energía, es decir, el orbital con la energía más baja se llenará primero y el orbital con la energía más alta se llenará el último.
La palabra 'Aufbau' en alemán significa 'construir'. La formación de orbitales significa llenar orbitales con electrones. Afirma que los electrones en los orbitales atómicos se llenan en orden ascendente de energía del orbital atómico. Y la energía del orbital atómico se calcula usando la regla n+l que establece si el electrón con un número mayor del valor n+l tiene mayor energía. En la regla discutida en la línea anterior, norte le dice el número cuántico principal y yo indica el número cuántico azimutal.
Si dos electrones tienen el mismo valor de n+l, entonces el electrón con un valor menor de norte tiene menor energía y se llena primero. El orden de llenado de los electrones en un orbital atómico se analiza a continuación.
tabla de verdad del sumador completo
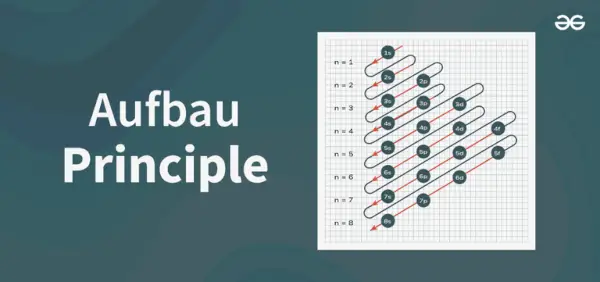
Estructura del diagrama de principio.
El diagrama del principio de Aufbau es el diagrama que representa el orden de llenado de los electrones en un átomo.
Estructura del diagrama de principio.
Estructura de la fórmula principal
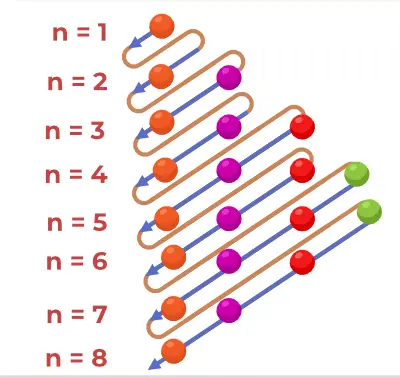
La fórmula del principio de Aufbau es la fórmula que indica el orden en que se llenan los electrones en el orbital atómico. La fórmula del orbital atómico es
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Estructura del principio Clase 11
El principio de Aufbau es un principio importante de la química para los estudiantes de la clase 11. Este principio establece que,
Los electrones en el orbital atómico de un átomo se llenan en el orden ascendente de la energía del orbital atómico que se calcula usando la regla (n+l).
Dibujar el diagrama de estructura.
El diagrama de Aufbau se dibuja siguiendo los pasos que se agregan a continuación,
- Encuentre el número de electrones que se deben llenar en los átomos.
- Sabemos que en un átomo el
- El orbital s puede contener un máximo de 2 electrones.
- El orbital p puede contener un máximo de 6 electrones.
- El orbital d puede contener un máximo de 10 electrones.
- El orbital f puede contener un máximo de 14 electrones.
- Complete los dos primeros electrones en el orbital 1s.
- Luego siga la regla n+l y luego llene los electrones en consecuencia.
Características destacadas del principio de estructura
Varias características del Principio de Aufbau son,
- La energía de un orbital depende de la suma de los valores del número cuántico principal (n) y del número suma azimutal (I). Esto se llama el (n + l) regla . Según esta regla,
- En un átomo neutro aislado, cuanto menor sea el valor de (n + l) para un orbital, menor será su energía. Sin embargo, si dos tipos diferentes de orbitales tienen el mismo valor (n + l), entonces los orbitales con un valor menor de n tienen menos energía.
| Tipo de orbital | Valor de n | valor de l | Valor de n+l | Energía relativa |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Energía más baja |
| 2s | 2 | 0 | 2+0 = 2 | Mayor energía que el orbital 1s. |
| 2p 3s | 2 3 | 1 0 comando de estiramiento de autocad | 2+1 = 3 3+0 = 3 | Los orbitales 2p (n=2) tienen menor energía que los orbitales 3s(n=3). |
| 3p 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | Los orbitales 3p (n=3) tienen menor energía que los orbitales 4s(n=4). |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 formatear cadena java | Los orbitales 3d (n=3) tienen menor energía que los orbitales 4p(n=4). |
De la descripción dada en la tabla se deduce que las energías de los distintos orbitales aumentan con el aumento del número cuántico principal.
- Así, el orden en que se llenan los electrones en el orbital atómico del átomo es, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Configuración electrónica utilizando el principio de Aufbau
El Configuración electrónica A continuación se analiza el uso del principio de Aufbau para algunos elementos:
Configuración electrónica del azufre
Número atómico de Azufre es 16, es decir, tiene 16 electrones
Ahora, usando el principio de Aufbau, la configuración electrónica del azufre se escribe como,
[S] = 1s 2 2s 2 2p 6 3s 2 3p 4
Configuración electrónica del nitrógeno
El número atómico del nitrógeno es 7, es decir, tiene 7 electrones.
Ahora, usando el principio de Aufbau, la configuración electrónica del nitrógeno se escribe como,
[N] = 1s 2 2s 2 2p 3
Excepciones al principio de construcción.
Hay algunas excepciones al Principio de Aufbau que son el Cromo y el Cobre. Su configuración electrónica es,
Configuración Electrónica de Cromo
La configuración electrónica del Cromo según el Principio de Aufbau debe ser
- Cr(24): [Ar]3d 4 4s 2
Pero la configuración anterior no es correcta porque la configuración electrónica real del cromo (Cr) es,
- Cr(24): [Ar]3d 5 4s 1
El motivo de esta configuración electrónica es que el El orbital atómico d medio lleno es más estable. que el orbital lleno según el principio de Aufbau.
Configuración Electrónica del Cobre
La configuración electrónica del Cobre según el Principio de Aufbau debe ser,
- Cu(29): [Ar]3d 9 4s 2
La configuración anterior no es correcta porque la configuración electrónica real del cobre (Cu) es,
- Cu(29): [Ar]3d 10 4s 1
El motivo de esta configuración electrónica es que el El orbital atómico d lleno es más estable. que el orbital lleno según el principio de Aufbau.
Leer más
- Números cuánticos
- Forma de los orbitales atómicos
- Estructura atomica
Principio de estructura: preguntas frecuentes
¿Qué es el principio de Aufbau en química?
El Principio de Aufbau en Química es el principio básico que se utiliza para llenar los electrones en los orbitales atómicos de cualquier átomo. Este teorema nos dice el orden en que se llenan los electrones en el orbital atómico.
java conectar con mysql
¿Quién dio el principio de Aufbau?
El Principio de Aufbau fue propuesto por el famoso físico danés Niels Bohr en 1920.
¿Qué es el principio de exclusión de Pauli?
El principio de exclusión de Pauli establece que en un átomo no hay dos electrones que tengan los cuatro números cuánticos. t el mismo. Al menos, uno de los números cuánticos es diferente para todos los electrones del átomo.
¿Qué es la regla n+l?
La regla n+l es la regla que establece que la energía de un orbital depende de la suma del Número Cuántico Principal (n) y el Número Cuántico Azimutal (l). esta regla se llama regla (n+l).
¿Cuáles son las excepciones al principio de Aufbau?
La excepción al principio de Aufbau son,
- Configuración electrónica del cromo Cr[24]
- Configuración electrónica del cobre Cu[29]
