Orbitales atómicos , que son funciones matemáticas, describen el comportamiento ondulatorio de los electrones (o pares de electrones) en un átomo. Los orbitales atómicos tienen diferentes formas según su tipo. Las diferentes formas de los orbitales atómicos describen que existe una probabilidad alta o nula de encontrar un electrón alrededor del núcleo en algunas direcciones. Hay cuatro tipos de orbitales, cada uno con una forma diferente y representados por las letras s, p, d y f. Los orbitales s y p se tienen en cuenta porque son los más abundantes en química química y biológica. Un orbital s tiene un núcleo esférico en el centro, un orbital p tiene forma de mancuerna, y cuatro de los cinco orbitales d tienen forma de trébol. El quinto orbital d tiene la forma de una mancuerna larga con un donut en el centro. Los orbitales de un átomo están organizados en capas o capas de electrones.
¿Qué son los orbitales atómicos?
Los orbitales atómicos son el espacio tridimensional cercano al núcleo de un átomo donde la posibilidad de descubrir un electrón es máxima.
Un átomo, según el modelo atómico cuántico, puede tener un número infinito de orbitales. Estos orbitales se pueden clasificar según su tamaño, forma u orientación. Un orbital más estrecho significa que hay una mayor probabilidad de atrapar un electrón cerca del núcleo. La función de onda orbital se conoce a menudo como una función matemática que se utiliza para expresar las coordenadas de un electrón. La probabilidad de localizar un electrón está representada por el cuadrado de la función de onda orbital. Esta función de onda también ayuda en la creación de diagramas de superficie límite.
Función de onda orbital
El modelo atómico cuántico predice que un átomo puede tener una gran variedad de orbitales. Estos orbitales se pueden agrupar según su tamaño, geometría o inclinación. Un tamaño orbital reducido aumenta la probabilidad de obtener un electrón cerca del núcleo. La función matemática utilizada para representar las coordenadas de un electrón se llama función de onda orbital . La probabilidad de descubrir un electrón está representada por el cuadrado de la función de onda orbital.
También podemos usar esta función de onda para crear diagramas de superficie límite. Podemos comprender mejor la forma de los orbitales utilizando diagramas de superficie límite de densidad de probabilidad constante para varios orbitales.
saltar lista
Formas de orbitales atómicos
Las formas de los orbitales atómicos varían. Es decir, las distribuciones de probabilidad de los electrones que describen rodeando el núcleo son diferentes. El hecho de que los electrones en diferentes orbitales probablemente estén ubicados en diferentes áreas alrededor del núcleo principal y, por lo tanto, experimenten la atracción de este último con intensidades variables es una de las razones por las cuales los orbitales varían en energía. Es sorprendente que todos los orbitales de una determinada capa del átomo de hidrógeno tengan la misma energía y al mismo tiempo tengan formas variadas. Esto se debe a la eliminación de diversos aportes relacionados con la energía.
Pero tan pronto como hay un segundo electrón, la degeneración desaparece.
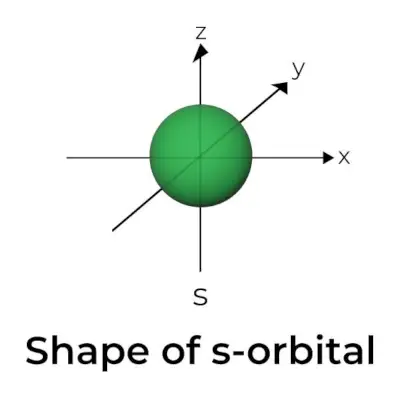
Forma del orbital s
- El diagrama de la superficie del límite orbital se asemeja a una esfera con el núcleo en su centro, que se puede representar en dos dimensiones como un círculo.
- Los orbitales s son esféricamente simétricos, lo que significa que la probabilidad de encontrar un electrón a una distancia determinada es la misma en todas las direcciones.
- También se muestra que el tamaño del orbital s aumenta a medida que aumenta el valor del número cuántico primario (n); por tanto, 4s> 3s> 2s> 1s.
- El punto nodal es un lugar donde no hay posibilidad de localizar el electrón. Los nodos se clasifican en dos tipos: nodos radiales y nodos angulares. La distancia desde el núcleo se calcula mediante los nodos radiales, mientras que la orientación está determinada por los nodos angulares.
Forma del orbital p
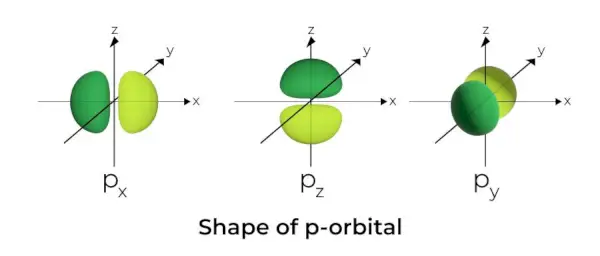
- Los orbitales p tienen forma de pesas.
- El nodo orbital p está ubicado en el centro del núcleo.
- Debido a la presencia de tres orbitales, el orbital p puede ocupar un máximo de seis electrones.
- Cada orbital p está formado por dos partes conocidas como lóbulos que se encuentran a cada lado del plano que atraviesa el núcleo.
- Cada orbital p tiene partes conocidas como lóbulos a cada lado del plano que atraviesa el núcleo. En el plano donde se cruzan los dos lóbulos, la probabilidad de encontrar un electrón es nula.
- Los tres orbitales se conocen como orbitales degenerados porque tienen el mismo tamaño, forma y energía.
- La única diferencia entre los orbitales es la orientación de los lóbulos. Debido a que los lóbulos están orientados a lo largo del eje x, y o z, reciben los nombres 2píxeles, 2py, y 2pz. La fórmula n –2 se utiliza para calcular el número de nodos.
- De manera similar a los orbitales s, el tamaño y la energía de los orbitales p aumentan a medida que aumenta el número cuántico primario (4p> 3p> 2p).
Forma del orbital d
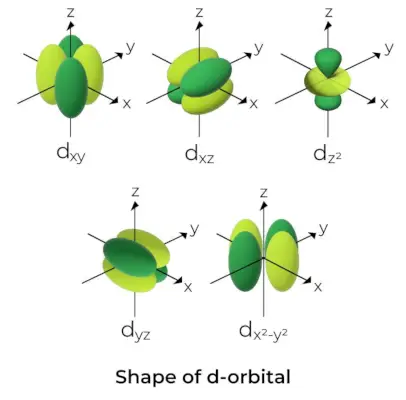
- Para los orbitales d, el número cuántico del orbital magnético viene dado como (-2,-1,0, 1,2). Como resultado, podemos afirmar que hay cinco orbitales d.
- Estos orbitales se indican con los símbolos d.xy, dyz, dxz, dX2–y2, y dCon2.
- Las formas de los primeros cuatro orbitales d son similares entre sí, lo que difiere del dCon2orbital, pero la energía de los cinco orbitales d es la misma.
Forma del orbital f
- La forma del orbital f está dispersa. Debido a que el valor de l=3 para el orbital f, el valor mínimo del número cuántico primario n es 4.
- Los valores equivalentes de ml para el orbital f son (-3,–2, –1, 0, +1, +2, +3).
- Como resultado, hay siete orbitales f para l = 3.

java booleano a cadena
Orbitales degenerados
Los orbitales degenerados son aquellos que tienen la misma energía. Estos orbitales son distintos (pueden estar orientados de manera diferente en el espacio alrededor del núcleo atómico ), pero tienen la misma energía. En presencia de un campo externo, la degeneración del orbital p no se ve afectada; sin embargo, la degeneración de los orbitales f y d se puede romper aplicando un campo externo al sistema (ya sea eléctrico o magnético).
Pocos orbitales tendrán mayor energía, mientras que otros tendrán menor energía. La degeneración ya no existirá en el sistema. Por ejemplo, los orbitales d se componen de cinco orbitales degenerados y todos tienen la misma energía.
Leer más:
- Teoría de los orbitales moleculares
- Llenado de orbital en un átomo
- Hibridación
Preguntas frecuentes sobre las formas de los orbitales atómicos
Pregunta 1: ¿Cómo funcionan los orbitales?
Respuesta:
eliminar caché npm
Un orbital atómico es una expresión matemática que expresa el comportamiento ondulatorio de un electrón o un par de electrones en un átomo en la teoría atómica y la mecánica cuántica. Cada orbital ocupará un máximo de dos electrones, cada uno con su propia cantidad de espín.
Pregunta 2: ¿Qué es el plano nodal?
Respuesta:
El plano donde la probabilidad de encontrar un electrón es insignificante o nula se llama Plano Nodal.
Pregunta 3: ¿Cuántos orbitales hay?
Respuesta:
Como el subnivel s tiene un solo orbital, sólo pueden estar presentes dos electrones. Como el subnivel p comprende tres orbitales, puede haber un máximo de seis electrones. Como el subnivel d comprende 5 orbitales, puede haber un máximo de 10 electrones. Y cada uno de los cuatro subniveles tiene siete orbitales que pueden contener un máximo de 14 electrones.
¿Qué tan grande es la pantalla de mi computadora?
Pregunta 4: ¿Qué orbitales tienen mayor energía?
Respuesta:
algoritmo knn
El orbital 1 tiene la mayor energía. La energía de un electrón es la cantidad de energía necesaria para sacarlo de la burbuja eléctrica del átomo.
Pregunta 5: ¿Cuál es la diferencia entre una capa y un orbital?
Respuesta:
En un átomo, una capa es una colección de subcapas de la misma teoría de números cuánticos, n. Cada uno de los orbitales tiene dos electrones, y los electrones en el mismo orbital tienen la misma definición de tamaño, tamaño del momento angular y número cuántico magnético.
Pregunta 6: ¿Qué es el enlace sigma y pi?
Respuesta:
La superposición de orbitales atómicos crea enlaces sigma y pi. Los enlaces sigma se crean superponiendo lóbulos orbitales atómicos, mientras que los enlaces Pi se generan cuando un lóbulo orbital atómico se superpone a otro.
