La base es un compuesto químico formado por OH.–iones y acepta protones. Las bases en química son aquellos compuestos que se vuelven azul tornasol rojo y cuando reaccionan con un ácido neutralizan la reacción para dar sal y agua. El valor de pH de la base es superior a 7. Las bases tienen un sabor amargo y son resbaladizas al tacto. Las bases que son solubles en agua se llaman álcalis. Ejemplos de Bases son Óxidos Metálicos, Hidróxidos Metálicos, etc. El jabón es un ejemplo de base que utilizamos en la vida diaria. En este artículo, aprenderemos en detalle la definición, las propiedades y las reacciones químicas de las Bases.

Definición básica
La base se define como el compuesto químico cuyo valor de pH es superior a 7, acepta un protón, neutraliza el ácido y convierte el tornasol rojo en azul. Generalmente liberan OH–ion en disociación. Los ejemplos incluyen NaOH, NaHCO3,etc. A continuación se muestran algunas características generales que muestra la base:
- Tienen un sabor amargo
- Son resbaladizos al tacto.
- Se vuelven azul tornasol rojo
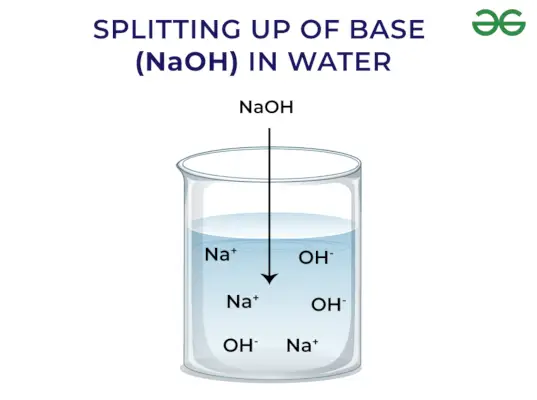
- Liberan OH–ion cuando se disuelve en agua
- Conducen electricidad en forma de solución.
Las bases son uno de los compuestos químicos más importantes que se utilizan en la vida cotidiana. Las bases se utilizan como antiácido para controlar la acidez y en pastas de dientes para neutralizar la acción bacteriana que produce ácido en nuestra boca y previene la degradación del esmalte y la caries. También se utilizan como polvo para hornear, bicarbonato de sodio y detergente en polvo.
Base Lewis
Las bases de Lewis son los compuestos que tienen pares de electrones y pueden donarlos a los compuestos que son deficientes en pares de electrones. Las bases de Lewis son de naturaleza nucleófila, es decir, aman los núcleos, lo que significa que atacarán un centro cargado positivamente con sus pares de electrones. Ejemplos de base de Lewis incluyen amoníaco porque en amoníaco (NH3) el átomo central de nitrógeno tiene 5 electrones de los cuales 3 se utilizan para formar enlaces con 3 átomos de hidrógeno y un par de electrones permanece con el átomo de N, formando así NH3una base Lewis.
Base Arrhenius
Según el concepto de Arrhenius, las bases son compuestos que liberan iones hidróxido cuando se disuelven en agua y aumentan la concentración de iones hidroxilo en la solución acuosa. Por ejemplo, cuando KOH se disuelve en agua dará OH–ion y así aumentar la concentración de OH–en el agua.
Base de Brønsted
El concepto de base de Bronsted es una versión avanzada del concepto de Arrhenius que establece que las bases son compuestos que aceptan H+ion o protón para formar su ácido conjugado. Por ejemplo cl–es una base que acepta H+para formar HCl como su ácido conjugado.
Tipos de bases
Las bases se pueden clasificar según su acidez, concentración y capacidad de ionización. La clasificación se menciona a continuación.
Tipos de bases según la acidez
La acidez de una base se refiere al número de grupos hidroxilo reemplazables presentes en una molécula de la base. Según la acidez, las bases se clasifican en tres categorías:
- Base monoácida
- Base diácida
- Base triácida
Monoácido: Las bases monoácidas son aquellas que contienen solo un ion hidroxilo reemplazable e interactúan con un solo ion hidrógeno. Las bases monoácidas incluyen NaOH, KOH y otras.
Diácido: La base diácida es una base con dos iones hidroxilo reemplazables que interactúan con dos iones de hidrógeno. Ca(OH)2, Mg(OH)2y otras bases diácidas son ejemplos.
golpe de división de cuerdas
Triácido: La base triácida es un tipo de base que comprende tres iones hidroxilo reemplazables y tres iones de hidrógeno. Las bases triácidas incluyen Al(OH)3, Fe(OH)3, y otros.
Tipos de bases según su concentración en solución acuosa
La concentración se refiere a la cantidad de base presente en una solución acuosa. Según su concentración en solución acuosa, las bases se dividen en dos categorías:
- Base concentrada
- Base diluida
Base concentrada: Las bases concentradas son aquellas en las que la cantidad de base es grande en comparación con la de disolvente. Por ejemplo, una solución concentrada de NaOH.
Base diluida: Este tipo de bases tienen una menor concentración de base en su solución acuosa. La dilución es el proceso de reducir el porcentaje de un soluto agregando más cantidad de solvente. Por ejemplo, diluya NaOH, diluya KOH, etc.
Tipos de bases según el grado de ionización
El grado de ionización se refiere a la capacidad de un compuesto químico de liberar su ion constituyente cuando se disuelve en agua. En el caso de la Base, el grado de ionización se refiere a la capacidad de la base para liberar OH.–iones cuando se disuelven en agua. Según el grado de ionización, las bases se clasifican en dos tipos:
- Base fuerte
- Base débil
Base fuerte: Las bases fuertes son aquellas bases que se disocian completamente y liberan iones OH- cuando se disuelven en agua. Algunos ejemplos de bases fuertes incluyen NaOH, KOH, etc.
Base débil: Las bases que no sufren una disociación completa y liberan sólo una fracción del ion OH- se denominan bases débiles. Ejemplos de bases débiles incluyen Al (OH)3,Cu(OH)2,etc.
Aprende más, Bases fuertes y débiles
Propiedades de las bases
Como sabemos, las bases son compuestos químicos que tienen iones OH-, se vuelven azul tornasol rojo, etc. En esta sección, aprenderemos sobre las propiedades físicas y químicas de las bases junto con un breve conocimiento de sus propiedades generales.
Propiedades generales de la base
Las propiedades generales de las Bases se mencionan a continuación:
- Un ion hidróxido (OH–) es liberado al agua por las bases. Cuanto más fuerte se vuelve la base, más iones se liberan.
- Las bases reaccionan con el ácido para formar sal. Los ácidos reaccionan con las bases. Esta reacción de una base con un ácido se llama reacción de neutralización.
- Las bases convierten el tornasol rojo en azul.
- La estructura de una proteína puede verse alterada por bases. Las bases tienen esta cualidad, lo que las hace sentir resbaladizas. El jabón es una base que se vuelve increíblemente resbaladiza sobre la piel cuando está mojada. Debido a su capacidad para modificar la estructura de las proteínas, algunas bases poderosas son extremadamente peligrosas.
Propiedades físicas de las bases
Las bases tienen un sabor amargo: Las bases tienen un sabor amargo. Debido a su amargor, sólo disponemos de unos pocos alimentos alcalinos. Sólo hay unos pocos materiales alimentarios alcalinos. Las bases deben probarse con más precaución que los ácidos.
Las bases son resbaladizas al tacto: Cuando se tocan, las bases se sienten resbaladizas. Por ejemplo jabón.
Las bases liberan OH – Ion: Cuando las bases se disuelven en agua liberan iones hidroxilo (OH–). Dependiendo de la capacidad de liberar iones hidroxilo se clasifican en fuertes y débiles.
Las bases neutralizan los ácidos: Cuando las bases reaccionan con los ácidos, se neutralizan entre sí y producen sal y agua. Esta reacción se llama Reacción de neutralización . Digamos que tenemos el ácido HY y la base 'XOH', entonces la sal formada será 'XY'. La ecuación para esta reacción se puede dar como HY + XOH → HOH + XY.
Bases que Desnaturalizan la Proteína: La desnaturalización de proteínas significa la destrucción de la estabilidad y estructura de la proteína. Esto hace que el uso de una base sea dañino para los humanos, ya que la piel y el cabello humanos están compuestos de proteínas y cuando se usan álcalis fuertes como el hidróxido de sodio o potasio, también llamado lejía, crean un impacto dañino en la piel humana.
Las bases convierten el tornasol rojo en azul: Cuando las bases entran en contacto con el tornasol rojo, lo vuelven azul. Sin embargo, cabe señalar que no se puede observar tal cambio cuando intentamos hacer reaccionar una base seca con papel tornasol rojo. La prueba del papel tornasol es uno de los métodos más antiguos para probar la base. Sin embargo, también existen otros indicadores como la fenolftaleína.
Bases Conductoras de Electricidad: Cuando las bases están en forma de solución, tienen iones OH- móviles, por lo que pueden conducir electricidad.
Propiedades químicas de las bases.
- Reacción de la base con metales: Cuando el álcali (base) reacciona con el metal, se produce sal y gas hidrógeno.
Álcali + Metal → Sal + Hidrógeno
actriz amrita rao
Ejemplos:
- Cuando el hidróxido de sodio interactúa con el aluminio metálico, se generan aluminato de sodio y gas hidrógeno.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2H 2
- Cuando el hidróxido de sodio interactúa con el zinc metálico, produce gas hidrógeno y zincato de sodio.
2 NaOH + Zn → Na 2 Zno 2 +H 2
- Reacción de Óxidos No Metálicos con Base: La sal y el agua se forman cuando los óxidos no metálicos reaccionan con una base.
Óxido no metálico + Base → Sal + Agua
Cuando el hidróxido de calcio, una base reacciona con dióxido de carbono, se produce carbonato de calcio y agua.
Ca(OH) 2 +CO 2 → CaCO 3 +H 2 oh
- Reacción de álcalis/base con sales de amonio: El amoníaco se produce cuando los álcalis reaccionan con las sales de amonio.
Álcali + Sal de amonio → Sal + Agua + Amoníaco
Cuando el hidróxido de calcio reacciona con el cloruro de amonio, se produce agua con cloruro de calcio y amoníaco.
Ca(OH) 2 + NH 4 Cl → CaCl 2 +H 2 O + NH 3
Ejemplos de bases
Las bases generalmente son Óxido Metálico, Hidróxido Metálico, Hidrogenocarbonato Metálico, Carbonatos Metálicos etc. Veamos algunos de los ejemplos de bases con su aplicación en forma de tabla:
| Bases | Aplicaciones |
|---|---|
| Hidróxido de potasio KOH | Utilizado en pilas alcalinas |
| Hidróxido de sodio NaOH | Utilizado en la fabricación de jabón y detergente. |
| Hidróxido de magnesio mg(OH) 2 | Utilizado como antiácido |
| Bicarbonato de sodio NaHCO 3 miflixr | Utilizado como bicarbonato de sodio. |
| Carbonato de sodio Ya 2 CO 3 | Utilizado como bicarbonato de sodio. |
| Amoníaco NUEVA HAMPSHIRE 3 | Utilizado en la fabricación de productos de limpieza y farmacéuticos. |
| Hidróxido de calcio Ca(OH) 2 | Utilizado en lavado de blanco. |
Usos de las bases
Existen varios casos de uso de base, algunos de estos son:
colecciones en java
- El hidróxido de sodio se utiliza en la fabricación de jabón y papel. El hidróxido de sodio (NaOH) también se utiliza en la producción de rayón.
- El polvo blanqueador está hecho de Ca(OH)2, comúnmente conocido como cal apagada o hidróxido de calcio.
- El hidróxido de calcio se utiliza para crear mezclas secas para pintar y decorar.
- El hidróxido de magnesio, conocido popularmente como leche de magnesia, es un laxante muy utilizado. También se utiliza como antiácido ya que disminuye el exceso de acidez en el estómago humano.
- En los laboratorios, el hidróxido de amonio es un reactivo crítico.
- La cal apagada se puede utilizar para neutralizar el exceso de acidez en los suelos.
Leer más
- Ácido, Base y Sal
- Fuerza del ácido
- Ionización de ácido y base.
Preguntas frecuentes sobre bases en química
1. ¿Qué son las Bases?
- Los compuestos básicos tienen un sabor amargo.
- La textura de la mayoría de las bases es jabonosa.
- Cuando se prueba en papel tornasol, transforma el papel tornasol rojo en papel tornasol azul en la mayoría de los casos.
- En solución, los compuestos básicos también conducen electricidad.
- Cuando los compuestos básicos se disuelven en agua, se liberan iones OH-.
2. ¿Cuáles son las funciones de las bases?
En casa utilizamos bases como agentes limpiadores y antiácidos. Los jabones, la lejía (que se utiliza en limpiadores de hornos), la leche de magnesia y los Tums son ejemplos de bases caseras populares. Cada uno de ellos tiene un pH superior a siete, puede consumir hidrógeno libre y neutralizar ácidos.
3. ¿Cuál es la distinción más importante entre un ácido y una base?
Ácidos y bases Hay dos tipos de productos químicos corrosivos. Los materiales ácidos tienen un valor de pH entre 0 y 7, mientras que las bases tienen un valor de pH entre 7 y 14. Los ácidos son sustancias químicas iónicas que se descomponen en el agua para crear el ion hidrógeno (H+), mientras que la base se disocia para dar el ion OH-.
4. ¿Cuáles son las propiedades físicas de las bases?
- Tienen un sabor amargo.
- Sus soluciones acuosas tienen una cualidad jabonosa.
- Cambian el color del papel tornasol de rojo a azul.
- Sus soluciones acuosas son conductoras de electricidad.
- Con la liberación de gas hidrógeno, las bases reaccionan con los metales para generar sal.
5. ¿Qué pasará cuando el hidróxido de calcio reaccione con el cloruro de amonio?
Cuando el hidróxido de calcio reacciona con el cloruro de amonio, se produce agua con cloruro de calcio y amoníaco.
Ca(OH) 2 + NH 4 Cl → CaCl 2 +H 2 O + NH 3
6. ¿Qué pasará cuando el hidróxido de sodio reaccione con el zinc metálico?
Cuando el hidróxido de sodio interactúa con el zinc metálico, produce gas hidrógeno y zincato de sodio.
2 NaOH + Zn → Na 2 Zno 2 +H 2
7. ¿Qué es la Base Lewis?
Las bases de Lewis son los compuestos que donan un par de electrones al compuesto deficiente en electrones. El ejemplo incluye NH3.
8. ¿De qué están hechas las Bases?
Las bases generalmente consisten en OH–ion. Además de estos óxidos metálicos, también son bases los carbonatos y los bicarbonatos.
9. ¿Qué son los álcalis?
Las bases que son solubles en agua se llaman álcalis. Un ejemplo es el hidróxido de sodio NaOH.
10. ¿Qué son base fuerte y base débil?
Las bases que se disocian completamente para dar OH–Los iones que se disuelven en agua se denominan bases fuertes. Los ejemplos incluyen NaOH. Las bases débiles son aquellas que no se disocian completamente para liberar OH.–El ion se llama base débil. Ejemplos de bases débiles incluyen hidróxido de amonio.
