El concepto de hibridación Se define como el proceso de combinar dos orbitales atómicos para crear un nuevo tipo de orbitales hibridados. Esta mezcla generalmente da como resultado la formación de orbitales híbridos con energías, formas, etc. completamente diferentes. La hibridación se lleva a cabo principalmente mediante orbitales atómicos del mismo nivel de energía. Sin embargo, tanto los orbitales completamente llenos como los medio llenos pueden participar en este proceso si sus energías son iguales. El concepto de hibridación es una extensión de la teoría del enlace de valencia que nos ayuda a comprender la formación de enlaces, las energías de los enlaces y las longitudes de los enlaces.
carácter java a int
¿Qué es la hibridación?
Cuando dos orbitales atómicos se combinan para formar un orbital híbrido en una molécula, la energía de los orbitales de los átomos individuales se redistribuye para dar orbitales de energía equivalente. Esto se conoce como hibridación.
Los orbitales atómicos de energías comparables se mezclan durante el proceso de hibridación, que implica principalmente la fusión de dos orbitales o dos orbitales 'p' o la mezcla de un orbital 's' con un orbital 'p' y un orbital 's'. orbital con un orbital 'd'.
Orbitales híbridos son los nuevos orbitales formados como resultado de este proceso. Más importante aún, los orbitales híbridos se pueden utilizar para explicar las propiedades de los enlaces atómicos y la geometría molecular. El carbono, por ejemplo, forma cuatro enlaces simples en los que el orbital s de la capa de valencia se combina con tres orbitales p de la capa de valencia. Esta combinación genera cuatro sp equivalentes3mezclas. Estos estarán dispuestos en un patrón tetraédrico alrededor del carbono, que está unido a cuatro átomos diferentes.
Pasos para determinar el tipo de Hibridación
Para comprender el tipo de hibridación en un átomo o un ion se deben seguir las siguientes reglas.
- Primero, determine el número total de electrones de valencia contenidos en un átomo o ion.
- Luego, cuente el número de pares solitarios unidos a ese átomo o ion.
- Ahora, el número de orbitales necesarios se puede calcular sumando el número de dúplex u octeto y el número de pares libres de electrones.
- Cabe señalar que la geometría de los orbitales en los átomos o en los iones es diferente cuando no existe un par de electrones solitarios.
Características de la hibridación
- La hibridación se produce entre orbitales atómicos con energías iguales.
- El número de orbitales híbridos formados es igual al número de orbitales atómicos que se mezclan.
- No es necesario que todos los orbitales medio llenos participen en la hibridación. Incluso pueden participar orbitales que están completamente llenos pero que tienen una energía ligeramente variable.
- La hibridación ocurre sólo durante la formación del enlace, no en un solo átomo gaseoso.
- Si se conoce la hibridación de la molécula, se puede predecir la forma de la molécula.
- El lóbulo más grande del orbital híbrido siempre es positivo, mientras que el lóbulo más pequeño del lado opuesto siempre es negativo.
Tipos de hibridación
La hibridación se puede clasificar como sp3, sp2, sp., sp3re, sp3d2, o sp3d3basado en los tipos de orbitales involucrados en la mezcla.
sp Hibridación
Ocurre cuando un orbital s y un orbital p en la capa principal de un átomo se combinan para formar dos nuevos orbitales equivalentes. Los orbitales recién formados se conocen como orbitales hibridados sp. Produce moléculas lineales en un ángulo de 180°. Implica combinar el orbital propio y un orbital 'p' de igual energía para producir un nuevo orbital híbrido conocido como orbital hibridado sp.
- También se conoce como hibridación diagonal.
- Cada orbital hibridado sp contiene la misma cantidad de caracteres s y p.
- Todos los compuestos de berilio, como el BeF.2, Bien2y BeCl2, son ejemplos.

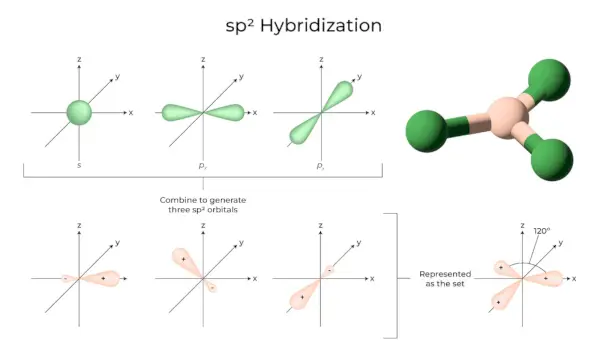
sp2Hibridación
Ocurre cuando uno s y dos orbitales p de la misma capa del átomo se combinan para formar tres orbitales equivalentes. Los orbitales recién formados se conocen como sp.2orbitales híbridos. También se conoce como hibridación trigonal. Implica combinar el propio orbital con dos orbitales 'p' de igual energía para crear un nuevo orbital híbrido conocido como sp.2. Una mezcla de simetría trigonal de orbitales s y p se mantiene a 120 grados. Los tres orbitales híbridos permanecen en el mismo plano y forman entre sí un ángulo de 120°.
- Cada orbital híbrido formado tiene un carácter 'p' de 33,33 % y 66,66 %.
- Las moléculas con forma plana triangular tienen un átomo central que está unido a otros tres átomos y es sp2hibridado. Los compuestos de boro son ejemplos.
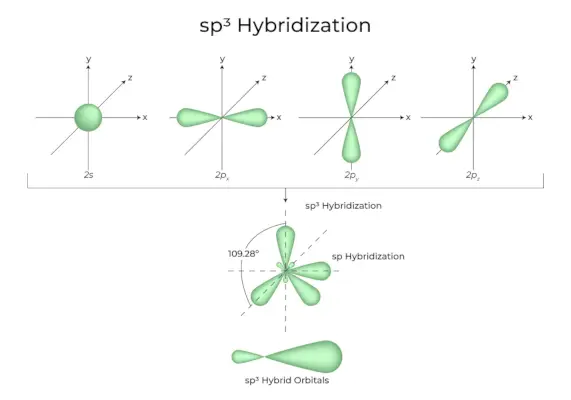
sp3Hibridación
Cuando un orbital 's' y tres orbitales 'p' de la misma capa de un átomo se combinan para formar cuatro nuevos orbitales equivalentes, la hibridación se conoce como hibridación tetraédrica o sp.3. Los orbitales recién formados se conocen como sp.3orbitales híbridos. Estos apuntan a las cuatro esquinas de un tetraedro regular y forman entre sí un ángulo de 109°28′.
- El SP3Los orbitales híbridos forman un ángulo de 109,28 grados.
- Cada orbital híbrido tiene un carácter 25% s y un carácter 75% p.
- El etano y el metano son dos ejemplos.
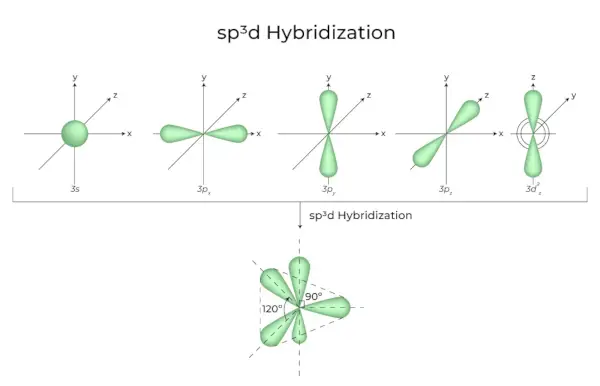
sp3d Hibridación
La mezcla de orbitales 1s, orbitales 3p y orbitales 1d da como resultado 5 orbitales hibridados sp3d de igual energía. Su geometría es bipiramidal trigonal. La combinación de orbitales s, p y d da como resultado una simetría bipiramidal trigonal. Los orbitales ecuatoriales son tres orbitales híbridos que están orientados formando un ángulo de 120° entre sí y se encuentran en el plano horizontal.
- Los dos orbitales restantes, conocidos como orbitales axiales, están en el plano vertical a 90 grados del plano de los orbitales ecuatoriales.
- Hibridación en pentacloruro de fósforo, por ejemplo (PCl5).
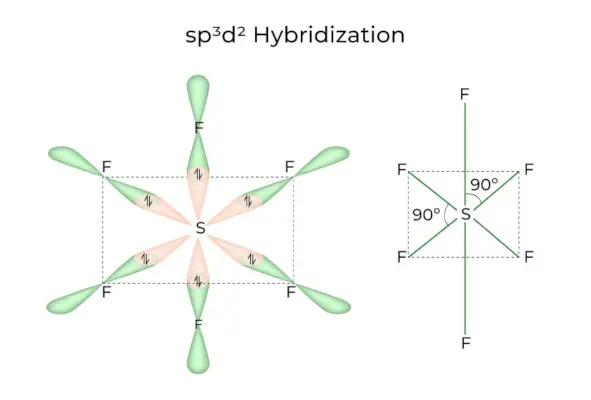
sp3d2 Hibridación
Cuando los orbitales 1s, 3p y 2d se combinan para formar 6 sp idénticos3d2orbitales híbridos, la hibridación se llama sp3d2Hibridación. Estos siete orbitales apuntan a las esquinas de un octaedro. Están inclinados entre sí formando un ángulo de 90 grados.
cómo ordenar una lista de matrices en java
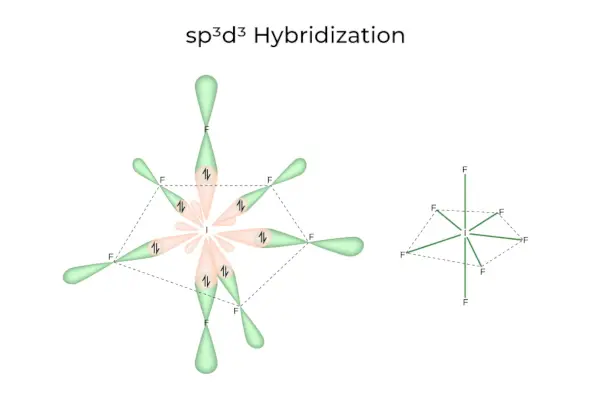
sp3d3Hibridación
Tiene orbitales 1s, 3p y 3d, que se combinan para formar 7 sp idénticos.3d3orbitales híbridos. Estos siete orbitales apuntan a las esquinas de una bipiramidal pentagonal. p.ej. SI6.
Formas de hibridación
- Lineal: La hibridación sp es causada por la interacción de grupos de dos electrones; el ángulo orbital es de 180°. Planar trigonal: están involucrados tres grupos de electrones, lo que da como resultado sp2hibridación; los orbitales están separados por 120°. Tetraédrico: están involucrados cuatro grupos de electrones, lo que da como resultado sp3hibridación; el ángulo orbital es 109,5°. Bipiramidal trigonal: cinco grupos de electrones están involucrados, lo que resulta en sp3d hibridación; los ángulos orbitales son 90° y 120°. Octaédrico: están involucrados seis grupos de electrones, lo que da como resultado sp3d2hibridación; los orbitales están separados 90°.
Preguntas frecuentes sobre Hibridación
Pregunta 1: Entre sp, sp2 y sp3, ¿qué orbital híbrido es más electronegativo?
Respuesta:
El porcentaje del carácter s en sp, sp.2y sp3El carbono hibridado es 50%, 33,33% y 25%, respectivamente. Debido a la forma esférica del orbital s, el núcleo lo atrae uniformemente desde todas las direcciones. Como resultado, un orbital híbrido de carácter s estará más cerca del núcleo y, por tanto, será más electronegativo. Como resultado, el carbono hibridado sp es el más electronegativo.
Pregunta 2: ¿Qué son los orbitales híbridos?
Respuesta:
Los orbitales híbridos se forman combinando orbitales atómicos estándar y dando como resultado la formación de nuevos orbitales atómicos.
Pregunta 3: ¿Cuáles son las cinco formas de hibridación?
Respuesta:
mvcjava
Lineal, trigonal plana, tetraédrica, trigonal bipiramidal y octaédrica son las cinco formas básicas de hibridación.
Pregunta 4: ¿Por qué la molécula de amida se parece a sp?3hibridado pero es sp2?
Respuesta:
Si el átomo está rodeado por dos o más orbitales p o tiene un par solitario capaz de saltar a un orbital p, el proceso general de hibridación cambiará. Como resultado, en el caso de una molécula de amida, el par solitario entra en un orbital p, lo que da como resultado tres orbitales p paralelos adyacentes.
Pregunta 5: ¿Qué es la regla de Bent?
Respuesta:
Un átomo central conectado a numerosos grupos en una molécula se hibridará, provocando que los orbitales con más carácter s se dirijan hacia grupos electropositivos y los orbitales con más carácter p se dirijan hacia grupos electronegativos.
